原标题:鼻咽癌免疫治疗的研究进展
鼻咽癌是东南亚地区的一种特有疾病,我国香港是鼻咽癌最高发的地区之一,因此它也成为了鼻咽癌研究的中心之一。
由于鼻咽癌以低分化和未分化癌为主,在最初诊断时超过一半的患者已是疾病晚期,并且约有10%的患者伴有远处转移。根据2012年全球癌症的统计数据,男性和女性鼻咽癌患者的年龄标准化发病率(ASR)分别为6.4/10万和2.4/10万。在中国,2015年有6万例新发鼻咽癌病例并且有3.4万例死于鼻咽癌。
因此鼻咽癌是一种严重危害人类健康的疾病。
鼻咽癌的传统治疗方式包括手术治疗、放疗和化疗,由于其解剖部位较深、解剖结构复杂限制了手术入路,并且其对放射线敏感,所以放射治疗一直是其主要的治疗方法。
研究表明,调强适形放射治疗(IMRT)联合化疗治疗鼻咽癌,患者5年局部无复发率估计为90%,然而5年总生存率仅为80%左右,远处转移已成为治疗失败的根本原因。
晚期或复发鼻咽癌的治疗主要为含铂全身化疗,局部晚期鼻咽癌的标准治疗方案是顺铂同步放化疗,并且尼妥珠单抗常常作为同步放化疗方案的治疗药物。
同步放化疗在改善局部进展期鼻咽癌的治疗结果方面具有重要意义,但是同步放化疗方案常会导致口腔干燥症、牙关紧闭症、继发性肿瘤等并发症,从而严重降低患者生活品质。因此既能提高患者的无病生存期,又能减少治疗相关并发症的新型疗法的研究具有重要的临床价值百科。
EBV病毒在鼻咽癌的疾病进展方面发挥着重要的作用,但它同时也为鼻咽癌的免疫治疗提供了独特的目标和机会。
目前正在积极研究的免疫疗法,主要通过激发和增强机体的免疫功能达到控制和杀灭肿瘤细胞的目的,其治疗方式最重要的包含过继性T细胞疗法、免疫检查点抑制剂和肿瘤疫苗等。
鼻咽癌的治疗方式复杂,最佳治疗方案常常涉及多学科的方法,随着精准医学的加快速度进行发展,将来有望能够准确的通过患者不同的临床分期和免疫状态优化治疗的组合,以获得最佳的临床效果。
01
过继性T细胞疗法
在近几年的大量研究中,针对EBV抗原的过继性T细胞疗法均取得了一些瞩目的成效。因为这种治疗策略有其独特的优点:T细胞与EBV抗原的结合具有高亲和力,并且能够进行大量的体外扩增以获得临床治疗数量。
在难治性转移性鼻咽癌患者的I/II期的研究中,EBV-CTL免疫疗法可以观察到持久的反应,但复发性转移性鼻咽癌患者的总体反应率较低。尽管反应率较低,实验中先前常规化疗后进展的2名患者对相同的化疗药物表现出更新、强烈的化疗反应,这表明此疗法废除了肿瘤之前的获得性耐药并启动患者的免疫系统,为化疗提供了更强的应答。
另有研究结果表明,使用AdEl-LMP多聚体扩增的T细胞过继免疫疗法可以稳定复发的难治性鼻咽癌并且无明显的毒性,此研究结果为正在进行的I/II期研究提供了研究思路:此疗法具有作为转移性鼻咽癌一线化疗后微小残留病巩固疗法的潜在作用。也有其他的研究表明,EBVINT治疗是安全的,可能为对常规治疗有抗药性的EBV阳性复发患者提供新的治疗选择。
化疗结合过继性CTLs治疗的相关研究表明,接受GC-CTL方案的复发和/或转移性鼻咽癌患者的中位生存期为29.9个月,PGC化疗方案为17.7个月,PGC-5-FU化疗方案为21.4个月;GC-CTL、PGC-5-FU和PGC方案的两年总生存率分别为62.9%、42.9%和29.5%;三年总生存率分别为37.1%、25%和16.4%;研究还发现LMP2特异性T细胞与存活率呈正相关(P=0.014)。
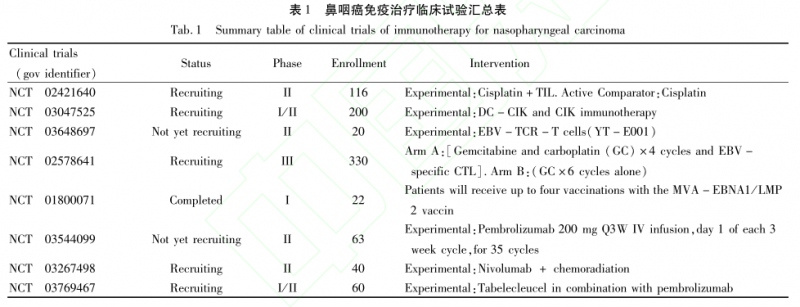
评价同步放化疗后TIL的治疗效果的II期临床试验(NCT02421640)正在开展中。最近的一项I/II期(NCT03047525)有关DC-CTL联合CIK治疗晚期实体瘤的研究也正在进行,后续结果的报道值得我们关注。
除此之外,有关EBV抗原特异性T细胞(YT-E001)的TCR-T细胞疗法的I/II期试验(NCT03648697)也正在进行中。目前一项有330名患者随访的III期临床试验(NCT02578641)也正在开展,比较卡铂与吉西他滨联合或不联合特异性CTL一线治疗转移性鼻咽癌,以评估其疗效及延迟不良反应。
这是第一个涉及鼻咽癌免疫治疗的多中心III期研究,所以后续结果的报道十分令人期待(表1)。
02
肿瘤疫苗
这种基于EBV的疫苗主要通过促进EBV特异性T细胞的产生和临床反应而不是抗原特异性抗体的产生来起杀伤肿瘤的作用。目前已经研究了两种用于鼻咽癌的治疗性疫苗,即基于肽的疫苗和DC疫苗。
与肽疫苗相比,DC疫苗显示出更强更显著的功效。Nagaoka等人的研究表明,DC疫苗可以诱导出5倍多具有多种功能和高增殖潜力的CTL。治疗性疫苗接种可能代表一种更快的治疗方法,到目前为止用于治疗和疫苗开发的靶向EBV蛋白主要是病毒复制感染过程中表达的病毒核抗原(EBNAs)和潜伏膜蛋白LMP1和LMP2。
而病毒包膜糖蛋白gp350是鼻咽癌预防性疫苗的主要靶点,诱导中和性抗体产生来阻断病毒对机体的感染通路。另一项研究表明,具有更多抗原结合的双特异性和多价抗体将改善疫苗的免疫原性,双特异性抗独特型抗体疫苗G22-I50可诱导强烈的体液和细胞介导的免疫应答,该疫苗可用于预防和治疗鼻咽癌。
一项动物实验表明,LMP1疫苗可以抑制体内表达LMP1的肿瘤生长和转移,除此之外,若在肿瘤攻击前给予LMP1疫苗,LMP1疫苗能够阻止表达LMP1的肿瘤发展。
另一项动物实验研究表明,在EBV-LMP2-CD 40 L DNA疫苗中编码EBV-LMP2肿瘤抗原可产生针对EBV肿瘤的有效抗肿瘤反应,这可能是提高DNA疫苗抗肿瘤免疫力的有效方法。并且有学者提出,免疫疗法和治疗性疫苗的结合可以进一步增强鼻咽癌患者的临床反应。
Taylor等人针对英国不同人群进行了一项剂量递增的Ia期试验,以确定MVA重组牛痘疫苗是否具有广泛的适用性,因为此疫苗是由中国产的EBV菌株构建的。
结果发现:疫苗接种不仅分别使14名患者中的7名(50%)和14名患者中的6名(43%)的EBNA-1和LMP2反应性提高了2倍以上;它还使表位特异性CD4+和CD8+T细胞的质量和频率分别增加到120%和420%,表现出了其增强的多功能性;最重要的是,EBV菌株变异和HLA多样性并没有改变疫苗的免疫原性,故此结果支持其在鼻咽癌最常见的东南亚地区应用。
并且目前正在进行I期试验(NCT01800071)以详细检测此疫苗的免疫原性,并测试第四个疫苗周期在已发病或缓解期的鼻咽癌患者中的潜在促进作用(表1)。
03
免疫检查点抑制剂
免疫检查点抑制剂在鼻咽癌中的应用一直是一个热门的研究话题,理想的免疫检查点抑制剂不但可以有效地“制动”免疫系统,并且可以重振内源性抗肿瘤免疫。
它主要的研究内容包括PD-1、PD-L1和CTLA-4,其中PD-1、PD-L1相关的研究近几年有较多的报道。虽然有关CTLA-4抑制剂对鼻咽癌疗效的临床试验报道较少,但是Huang等人的研究显示,CTLA-4过表达也可能是鼻咽癌的一项不良预后指标。
之前便有研究表明,在超过50%至80%的鼻咽癌组织和临床前模型中发现PD-L1表达,并且PD-L1可以被EB癌蛋白LMP-1通过激活STAT3、蛋白-1(AP-1)以及NF-κB通路而诱导表达。并且研究发现PD-1通过与T细胞上的PD-L1相互作用抑制T细胞受体下游的信号传导,除此之外,研究发现PD-L1还能够最终靠促进T细胞凋亡和诱导调节性T细胞介导免疫抑制。
部分学者在2012年的ASCO年会上首次报道了免疫检查点抑制剂nivolumab(BMS-936558/MDX1106)的I期临床实验结果,虽然其有不容忽视的免疫相关不良反应(IrAE),但是此疗法还是显示出了可喜的治疗效果,从此阻断PD-1/PD-L1信号通路的单克隆抗体成为鼻咽癌免疫治疗的一个新型治疗手段,并且目前慢慢的变成了鼻咽癌的一线治疗方式之一。
目前,已有相当多的免疫检查点抑制剂获得了食品和药物管理局的批准,其中与鼻咽癌治疗相关的2种免疫检查点抑制Pembrolizumab、Nivolumab,无论是单独使用还是与现有的传统疗法结合使用,均显示出较为理想的抗肿瘤作用。研究表明,Pembrolizumab在复发或转移性鼻咽癌患者中显示了良好的抗肿瘤活性和可控的安全性。在一项正在进行的研究(NCT03544099)中,对于检测EBVDNA的放化疗治疗后的患者将给予Pembrolizumab治疗,并测量EBVDNA的OR率和清除效率。
Nivolumab刚刚完成了II期试验,初步结果显示,它在复发或转移的患者中有活性,并且PD-L1表达可预测Nivolumab的获益。最新的研究表明,Nivolumab具有较好的活性,没有意料之外的毒性,并且1年的总体存活率优于相似人群的历史数据。
在另一项试验(NCT03267498)中,研究人员正在研究化学治疗和Nivolumab联合治疗II-IVb期鼻咽癌患者的疗效。并且有报道表明,Pembrolizumab联合化疗可以取得较好的临床效果,但是这仅是个案报道,Pembrolizumab联合化疗的治疗效果有待大样本的临床研究进一步证实。
有关Tabelecleucel与Pembrolizumab联合治疗鼻咽癌(ATA129-NPC-202)的I/II期的临床研究(NCT03769467)正在进行中。有关PD-L1的表达在包括鼻咽癌在内的几种肿瘤中的预测价值百科有较大争议。Lee等人的一项研究表明,在鼻咽癌肿瘤细胞中有大量PD-L1表达,而高PD-L1表达(IHC2+)与更好的局部无进展生存及PFS相关。
然而与此研究相反,Chan等人的一项研究表明在鼻咽癌患者中并没有观察到PD-L1表达水平的预后价值百科。同样Ma等人的研究也表明,患者的生存与PD-L1表达或血浆Epstein-Barr病毒的DNA清除之间无关联。
Ratcliffe等人的研究表明,即使使用相同的肿瘤标本,PD-L1的免疫组化结果可以随着不同的抗PD-L1抗体及测试平台的变化而变化,并且评分算法和截止定义的差异也会影响研究的结果。所以,上述研究差异可能是由多重原因造成的,例如不同的鼻咽癌研究中使用的PD-L1抗体和评分算法存在不同以及入组患者基线特征存在差异。
有关最新的重组人源化抗PD-1单克隆抗体TAB001的I期临床研究正在进行。以上的这些研究结果将为免疫检查点抑制剂的临床应用提供非常有价值百科的参考信息(表1)。
鼻咽癌是我国最常见的头颈部肿瘤,除了传统的手术治疗、放疗和化疗,新兴的免疫治疗为鼻咽癌患者提供了更多的治疗选择。虽然免疫治疗的临床疗效值得肯定,但是此疗法也有其不容忽视的缺点,例如DC疫苗的临床疗效虽然值得肯定,但是DC疫苗对体外细胞培养的设备和人员的要求较高,这是大规模应用的障碍。
并且治疗性疫苗需要将减毒的全部或部分病原体注入宿主体内,因此安全性是必须解决的问题。此外EBV病毒只感染人类,这一感染特性导致动物模型缺乏,因此用于评估疫苗临床应用价值百科的动物模型的构建和选取是目前病毒疫苗研究的一大难题。
耐药是免疫检查点抑制剂面临的主要问题,研究显示:在接受抗PD-1治疗的患者中,观察到的耐药性约高达60%。因此,如何克服免疫检查点抑制剂的耐用性是接下来面临的新挑战。
除此之外,有研究表明,免疫耐受是免疫治疗的主要障碍,吲哚胺2,3-双加氧酶(IDO)是一种IFNγ诱导酶,是肿瘤发展过程中免疫耐受的主要诱导剂;然而硼替佐米可以下调IFNγ诱导的IDO表达。
硼替佐米的这种抗肿瘤机制可能对临床癌症的免疫治疗提供新思路,特别是将硼替佐米与鼻咽癌相关的肿瘤疫苗联合起来预防和治疗鼻咽癌。肿瘤免疫抑制是肿瘤发生的重要机制,如何解决肿瘤的免疫抑制是免疫治疗研究的另一大难题。
最近有研究表明ANXA2与DC-SIGN分子的相互作用可以引起免疫抑制,导致肿瘤免疫逃逸,因此开发ANXA2靶向治疗有可能克服ANXA2高表达的鼻咽癌患者的耐药。近期慢慢的变多的研究数据支持将免疫治疗与传统疗法结合,例如将免疫节点抑制剂与化疗或放疗结合,这不仅为鼻咽癌患者提供了更多的选择,也为鼻咽癌的综合治疗及个体化治疗提供可能。
将鼻咽的免疫治疗与传统疗法结合的综合治疗并不是简单地将各种现有的手段随机组合,而是要摸索出能达到最高协同作用的治疗组合。虽然EBV相关鼻咽癌的大多数免疫治疗策略目前仍处于临床试验阶段,但是在前期研究成果的基础之上,加上不断涌现的最新研究成果,将推动鼻咽癌的免疫治疗走向新的台阶。
节选自:Modern oncology 2019,27(23):4308-4311
肿瘤医学论坛综合整理
关于我们
诺恩诺德医学研究院(北京)有限公司比较医学中心(以下简称“诺恩诺德比较医学中心”),是我院很重要的一个临床前研究机构与实验中心。它为公司CRO业务的承接、为公司肿瘤技术与产品的开发、为PDX的的临床的应用与研究提供了保障和基础。
诺恩诺德比较医学中心负责人黎立博士,原为中国人民解放军总医院第八医学中心比较医学中心(实验动物中心)负责人,曾参与国家“十二五”、“十三五”专项课题10余项,曾参与国家自然科学基金项目20余项,曾参与完成国家自然科学基金课题10余项,参与完成军队科研课题20余项;获得国家发明专利8项,发表学术论文30余篇。
黎立博士师从郑兆荣教授,郑兆荣教授为吉林大学(中国人民解放军农牧大学)教授、病理解剖学教研室主任、第六届全国政协常委,长期从事病理形态学的研究。同时,黎立博士也与临床医学相关院士保持着良好的合作伙伴关系。
未来,诺恩诺德比较医学中心将在CRO服务、PDX的临床应用与研究、肿瘤技术与产品的开发、药品、特医食品、医疗器械的研发中,获得更大的成绩,并将为公司在发明专利、课题申报方面做出贡献。
 客服热线:
客服热线: